Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
由良 敬; Kim, O.*; 郷 信広
no journal, ,
国際構造ゲノミクスプロジェクトにより、タンパク質立体構造座標情報が大量に産出されることになった。これらに基づいてタンパク質がどのようにして機能を発揮するかが明らかにできるはずである。機能の発現メカニズムを理解するためには、タンパク質のどの部分で機能が発現されているかを計算科学の手法で推定し、実験的に確かめる必要がある。そこでわれわれはいろいろなタンパク質の機能のうち、DNA/RNA/タンパク質との相互作用を取り上げた。これらの相互作用面を、タンパク質立体構造情報と分子進化情報に基づいて推定する方法を開発した。
新井 栄揮; 玉田 太郎; 本庄 栄二郎; 前田 宜丈*; 黒木 良太
no journal, ,
マウス抗体TN1は、巨核球系細胞の増殖・分化及び血小板産生を促進するサイトカインであるヒト・トロンボポエチン(hTPO)を認識する。われわれは、TN1抗体によるhTPO中和活性の発現機構の解明のために、TN1由来Fab単体のX線結晶構造を2.0 分解能で決定し、TN1由来Fab-hTPO複合体中のFabの構造と比較した。その結果、TN1抗体によるhTPO認識は、超可変領域(CDR領域)の主鎖構造がほとんど変化せず、ごくわずかに生じた側鎖レベルでのInduced-fitに基づくことが明らかになった。また、TN1由来Fab-hTPOの結合反応について等温滴定熱量測定を行った結果、2,920
分解能で決定し、TN1由来Fab-hTPO複合体中のFabの構造と比較した。その結果、TN1抗体によるhTPO認識は、超可変領域(CDR領域)の主鎖構造がほとんど変化せず、ごくわずかに生じた側鎖レベルでのInduced-fitに基づくことが明らかになった。また、TN1由来Fab-hTPOの結合反応について等温滴定熱量測定を行った結果、2,920
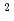 の接触面積変化に相当する
の接触面積変化に相当する 446.4kJ/mol/Kの構造エントロピー変化が観測された。この結果は、上記結晶構造解析の結果から判明している接触面積変化の値(1,580
446.4kJ/mol/Kの構造エントロピー変化が観測された。この結果は、上記結晶構造解析の結果から判明している接触面積変化の値(1,580
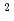 )よりも大きい。FabのCDRの構造はほとんど変化しないことから、この接触面積変化の差はFabの結合によってhTPOの構造変化が生じていることを示唆する。
)よりも大きい。FabのCDRの構造はほとんど変化しないことから、この接触面積変化の差はFabの結合によってhTPOの構造変化が生じていることを示唆する。
石田 恒; 由良 敬
no journal, ,
Ribosome is one of the supra-biomolecules used in the process of translating genetic information to polypeptides. In order to understand the dynamic properties of the ribosome and the nascent polypeptide, molecular dynamics simulations of the 70S ribosome were performed. A principal component analysis (PCA) on dynamics trajectories revealed collective motions of the 70S ribosome and a low frequency mode showed a so-called ratchet-like motion of the 30S and 50S subunits. We further performed steered molecular dynamics simulation and pulled the nascent polypeptide during the simulation to observe the interactions between the nascent polypeptide and a gate of the tunnel formed by the L4 and L22 proteins. This gate has been considered flexible and to play an active role in the elongation of the nascent polypeptides. Our simulation, however, suggested that the gate was not as flexible as was generally thought.
徳久 淳師; 石田 恒; 松本 淳; 河野 秀俊; 郷 信広
no journal, ,
これまでの構造解析は、ブラッグの散乱条件を用いた結晶構造解析が大部分を占め、構造を決定するには試料の結晶化が必要不可欠であった。しかし結晶化ができる生体高分子はごく一部である。このような背景のもと、X線自由電子レーザーを用いた、非結晶状態での生体高分子の立体構造決定法に大きな期待が寄せられている。本研究では計算科学的手法により、単分子X線構造解析の実現に向け、生体高分子の回転の影響及び、構造揺らぎの影響がスペックル散乱パターンに与える擾乱の程度を評価し、散乱パターンの分類法、及び立体構造構築法を確立することを目的とする。本年会では、単分子X線散乱データからの立体構造構築法の概要について報告する予定である。
米谷 佳晃*; 藤井 聡*; 皿井 明倫*; 河野 秀俊; 郷 信広
no journal, ,
DNAの柔らかさは塩基配列に依存し、その配列による違いが蛋白質との複合体形成の親和性を大きく左右することがある。そのため、DNAの柔らかさの塩基配列依存性は、蛋白質との相互作用を考えるうえで重要な性質である。一方、DNAの水和構造も塩基配列に依存することが知られている。例えば、配列5'AATT3'の場合には、副溝に沿って水分子が連なった秩序構造(スパイン)が形成されるが、5'TTAA3'の場合には形成されにくいことが、これまでのX線結晶構造解析から示されている。このような水和秩序構造の発見により、それがB型DNAの構造安定性に影響しているのではないかと考えられるようになったが、さまざまな配列に対して、水和構造とDNAの柔らかさがどのように関係しているかよくわかっていない。本研究では、両者の関係を明らかにするために、DNAの柔らかさと水和構造をさまざまな配列について系統的に調査した。DNAの柔らかさについては、すでに4塩基配列の全配列パターン(136通り)について分子動力学計算を行い、その配列依存性を導いている。今回は、さらに136通りの配列パターンについて水和構造を解析した。導かれた水和構造をDNAの柔らかさと比較し、DNAの柔らかさに対する水和構造の変化、そしてその配列による違いを示した。水和構造とDNAの柔らかさが互いにどのように影響しあっているのかを議論する。
中川 洋; 片岡 幹雄
no journal, ,
蛋白質の動力学転移がなぜ水和で生じるのかを明らかにすることを目的とし、非干渉性中性子非弾性散乱と分子シミュレーションによって動力学転移における水和水の構造やダイナミクスを調べた結果を報告する。まず蛋白質の水和量を段階的に変えることで動力学転移が水和量に応じてどのように変化するかを調べた。その結果、水和量が約0.3(g water/g protein)以上で動力学転移が顕著に現れることがわかった。なぜ動力学転移がこのような水和依存性を示すのかを明らかにするために、中性子散乱の同位体効果を利用して水和水のダイナミクスを直接観測した。その結果、転移温度以下の低温では水和量に関係なくタンパク質と水分子の揺らぎの大きさはほぼ同じであった。また転移が生じない低い水和量の場合では転移温度以上でもやはりタンパク質とほぼ同じであった。一方、動力学転移が生じる高い水和量の場合には転移と同時に水和水の揺らぎが大きくなっていることが明らかになった。蛋白質表面の水和水の構造的な考察から、約0.3(g water/g protein)の水和量を超えると水和水間の接触が顕著になる(水和水のパーコレーション転移)と考えられた。分子シミュレーションによって蛋白質水和水の構造をさまざまな水和量で調べた結果、高い水和量では水和水間の水素結合ネットワークが蛋白質表面を取り囲んでいることが観測された。以上の結果から、蛋白質の動力学転移は水和水のパーコレーション転移と密接な関係があるといえる。
玉田 太郎; 木下 誉富*; 大原 高志; 栗原 和男; 多田 俊治*; 黒木 良太
no journal, ,
エラスターゼは、立体構造情報を基盤とした創薬手法いわゆるStructure-Based Drug Design(SBDD)研究の代表的な題材として用いられてきたセリンプロテアーゼである。エラスターゼの活性部位に存在する触媒基の状態や阻害剤との相互作用を詳細に解析することは、SBDDにおいて有用な知見を与えると考えられる。そこで、エラスターゼと阻害剤複合体の中性子構造解析を実施した。中性子回折実験から得られた核密度図からその立体構造モデル(全原子座標: 約4,000個、そのうち水素及び重水素原子座標: 約2,000個)を構築した。構築した立体構造は1.75 分解能において、結晶学的R値: 23.4%まで精密化を終了している。中性子回折実験により得られた核密度図から、活性部位の解離状態や薬物候補化合物との水素結合様式が詳細に明らかになってきた。また、同一結晶から取得した核密度図(中性子)と電子密度図(X線)の差分を取ることにより、各原子の原子散乱長(因子)の特徴を反映したさまざまな情報を得ることができた。
分解能において、結晶学的R値: 23.4%まで精密化を終了している。中性子回折実験により得られた核密度図から、活性部位の解離状態や薬物候補化合物との水素結合様式が詳細に明らかになってきた。また、同一結晶から取得した核密度図(中性子)と電子密度図(X線)の差分を取ることにより、各原子の原子散乱長(因子)の特徴を反映したさまざまな情報を得ることができた。
松本 富美子; 前田 佳代*; 似内 靖*; 小田 俊郎*; 前田 雄一郎*; 藤原 悟
no journal, ,
遺伝性心筋症(HMC)は心臓の収縮機能やカルシウム調節に異常をきたす疾患で、筋収縮調節を担う蛋白質であるトロポニン(Tn;TnT, TnI, TnCからなる複合体)の変異により生じることが報告されている。われわれはTnの変異により生じるHMCの発症原因を探るため、Tn結晶構造中でIT-armと呼ばれるコイルドコイル中に存在する2つの変異(TnT(E244D), TnT(K247R))に注目して研究を行った。これまで、TnT(E244D)変異は心筋のカルシウム感受性を変えることなく最大張力を増大させるという報告があるが、TnT(K247R)についての報告はまだない。われわれは、これらの部位に種々の変異を導入し(E244; D, M, A, K and K247; R, E, A)、それにより生じる筋原繊維の機能異常を系統的に調べた。その結果、われわれは、IT-arm中に存在する2つの心筋症型変異が、同様の機能異常を引き起こすことを明らかにした。さらにこれらの部位が、IT-armの柔軟性を決定付けさせるような非常に特徴的なアミノ酸ネットワークを形成していることを見いだした。発表では変異により生じると考えられるIT-armの柔軟性変化と機能異常との関連について述べ、HMCの原因について考察する。
黒木 良太
no journal, ,
タンパク質を取り巻く溶媒の水和や脱水和は、タンパク質のフォールディング,ダイナミクス及び分子認識において重要な役割を演じる。中性子結晶解析は水素原子との強い相互作用により、タンパク質を構成する全原子の構造解析を可能にする。しかしながらタンパク質の周りに結合する水和水やカウンターイオンを電子密度だけから識別することは大変難しい。そこで原子との相互作用の特徴が異なるX線と中性子を相補的に利用して、溶媒に含まれる水和水や無機イオンの同定を試みている。試料としてブタエラスターゼの結晶を用い、1つの結晶からX線と中性子の回折データを収集した。両マップを比較することによって、水分子の位置を正確に同定することができた。現在この手法を用いてさまざまなカウンターイオンの位置の同定を試みている。このような水分子やカウンターイオンを同定する機能を、将来的にはわれわれが運営する生体水素水和水データベースの付加機能の一つとして加える予定である。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
テラヘルツ波領域にあるタンパク質鎖の原子の集団運動である低周波振動運動はその生体機能に重要な役割を果たすと考えられている。その役割を明らかにするためには、生体機能中にあるタンパク質のそのような運動を時分割で調べる必要がある。そこで、われわれは高強度フェムト秒レーザーを光源とし、チャープパルスを用いたマルチチャンネル検出を用いた光ポンプ・テラヘルツプローブ分光装置の開発を行った。この手法は機能過程中に時分割かつ単発で低周波振動吸収スペクトルの測定を可能とする。一方、従来のタンパク質のTHz分光のほとんどは凍結乾燥試料を対象にし、水溶液中タンパク質を対象にした研究はない。その最大の理由は溶媒である水のTHz波の吸収が大きいために、タンパク質起因の吸収信号が得られないためである。タンパク質は水中で機能を果たすからタンパク質水溶液を対象にしたTHz波吸収測定が必要である。そこで、われわれはタンパク質水溶液を逆ミセル中に閉じこめ、溶液中の水の割合を圧倒的に減らすことによりタンパク質起因のTHz吸収信号が得られることを明らかにした。
安達 基泰; 玉田 太郎; 栗原 和男; 大賀 拓史*; 倉光 成紀*; 黒木 良太
no journal, ,
ADPリボースピロフォスファターゼ(ADPRase)は、ADPリボースをリボース5'リン酸とAMPに加水分解する酵素である。本研究では、中性子結晶構造解析によって、ADPRaseの触媒反応に関与する水分子の役割や解離性アミノ酸のイオン化状態を明らかにし、触媒機構を詳細に解明することを目的としている。大腸菌を用いて組換え型ADPRaseを調製後、マクロシーディング法によって3.2 2.8
2.8 1.5(13mm
1.5(13mm )の結晶を取得した。得られた結晶を20日間重水素化溶液中にソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で分解能2.1
)の結晶を取得した。得られた結晶を20日間重水素化溶液中にソーキングを行った後、JRR-3の回折計BIX-3を用いて回折データを測定した。予備的解析実験の結果、露光時間240分で分解能2.1 , R-merge9.7%,完全性73.1%の回折データが得られた。
, R-merge9.7%,完全性73.1%の回折データが得られた。
藤原 悟; 小田 俊郎*; Plazanet, M.*; 松本 富美子
no journal, ,
アクチンは、ほぼすべての真核細胞内に存在し、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさのゆえである。F-アクチンの柔らかさの起源を明らかにするための第一段階として、われわれはピコ領域におけるアクチンの運動特性の測定を、中性子非干渉性弾性散乱(EINS)及び準弾性散乱(QENS)法を用いて行った。EINS測定により見積もられたアクチン分子内の原子の平均自乗変位の温度に依存した振舞がG-アクチンとF-アクチンで異なることが示された。また、QENSスペクトルから、アクチン分子内の原子の運動は、制限された空間内における拡散的運動として記述できること、並びにスペクトルがG-アクチンとF-アクチンで異なることが明らかとなった。これらのスペクトルの解析の結果、アクチンは、G-アクチンとF-アクチンで同様の柔らかさを持つ領域と、G-アクチンにおいてより柔らかくなる領域という動的不均一性を持っていることが示唆された。
松本 淳; 鎌田 徹治*; 岩崎 憲治*; 高木 淳一*; 由良 敬
no journal, ,
巨大な細胞外部分を持つ膜タンパク質であるインテグリンは、多細胞生物の細胞間接着に関与している。多くの種類のあるインテグリンのうち、活性化の際、大規模な構造変化を起こすものがあるが、その構造変化のメカニズムについては、ほとんどわかっていない。インテグリンのエラスティックネットワークモデルに対して、基準振動解析を行った結果、分子の内部運動に大きな影響のある相互作用を発見した。その相互作用に関与する部位の重要性は、実験でも確認された。